Den State of the Art gezielt erkennen, aufbauen und nutzen
26/11/2020
Do you have any questions about the article or would you like to find out more about our services? We look forward to hearing from you!Make a non-binding enquiry now
Wer eine klinische Bewertung durchführt, kommt um ihn nicht herum: der klinische Hintergrund, das derzeitige Wissen, der technisch-wissenschaftlich-medizinische Kenntnisstand. Doch nicht nur für die klinische Abteilung ist er maßgebend, er ist genauso wichtig für die Entwicklung. Wozu wird er benötigt und wie ist er aufgebaut? Wer die erste Frage beantworten kann, weiß eigentlich um die zweite automatisch Bescheid. Dennoch sollen hier beide Fragen angegangen werden. Außerdem wird beantwortet, wie Sie Ihre klinische Daten mit ihm vergleichen.
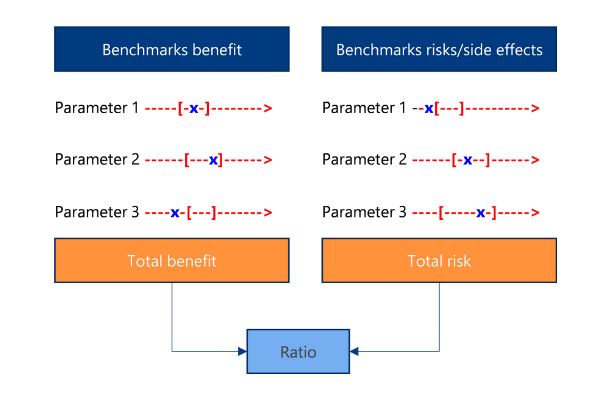 Die MDR verlangt Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen Ihres Produkts. Die Daten von similar devices gaben den State of the Art vor, nämlich die relevanten Parameter, die Messgröße und den Bereich, in dem die zugehörigen Messwerte üblicherweise liegen (in rot). Die Daten von equivalent devices und natürlich Ihrem eigenen Produkt bestimmen Ihre Position darin (in blau). Alternative Produkte und Therapien - relevant sind solche mit vergleichbaren Benefit- und Risiko-Parametern - haben wiederum ihre eigene Position.
Die MDR verlangt Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen Ihres Produkts. Die Daten von similar devices gaben den State of the Art vor, nämlich die relevanten Parameter, die Messgröße und den Bereich, in dem die zugehörigen Messwerte üblicherweise liegen (in rot). Die Daten von equivalent devices und natürlich Ihrem eigenen Produkt bestimmen Ihre Position darin (in blau). Alternative Produkte und Therapien - relevant sind solche mit vergleichbaren Benefit- und Risiko-Parametern - haben wiederum ihre eigene Position.
Die Erwartungshaltung im medizinischen Umfeld
Ihr Produkt leistet etwas und das führt zu einem klinischen Nutzen für den Patienten. Ihr Produkt hat auch Risiken und Nebenwirkungen, leugnen Sie es nicht. Dies ist der durchgehende Tenor der Grundlegenden Sicherheits- und Leistungsanforderungen. Sie müssen am Ende entscheiden und verantworten, ob der Nutzen und die Risiken in einem vertretbaren Verhältnis zueinanderstehen. Diese Entscheidung können Sie nicht völlig frei vornehmen! Sie orientieren sich am State of the Art. Der State of the Art entsteht, weil es "da draußen" mehr oder weniger viele ähnliche Produkte gibt, die von relevanten Fachkräften verwendet und mit denen Erfahrungen gesammelt werden. Dort bilden sich klinische Meinungen und Erwartungshaltungen. Dort entstehen mit der Zeit die medizinische Landschaft und ein Consensus über die Anwendung der Produkte, über Erfolg und Risiken. Dort stellen sich auch diagnostische und therapeutische Alternativen dar und werden diskutiert, denn je nach Situation, Krankheit oder Patientengruppe mag das eine oder das andere Produkt oder eine andere Therapie besser geeignet oder sicherer sein – nicht notwendigerweise beides gleichzeitig.Sie müssen sich dem State of the Art stellen. Die Performance Ihres Produktes und noch wichtiger der klinische Nutzen, der am Ende einzig relevant für den Patienten ist, müssen der etablierten Erwartungshaltung weitgehend entsprechend. Ebenso müssen die Risiken und Nebenwirkungen weitgehend in dem Rahmen bleiben, der von der klinischen Fachwelt erkannt und akzeptiert wird. Sie müssen nicht besser sein (wir sind hier nicht in der Nutzenbewertung, das ist ein anderes wenn auch nicht allzu weit entferntes Thema), die Mischung macht’s. Der State of the Art gibt den derzeit akzeptierten Rahmen vor.Der Aufbau des produktspezifischen State of the Art
Ermitteln Sie die Benchmarks
Gerade zu Beginn einer Produktidee, und dann durchgehend bis zur klinischen Bewertung, müssen Sie in Erfahrung bringen, welche Parameter es konkret sind, die die Performance und den klinischen Nutzen ausmachen. Nach was wird das Produkt bemessen? Ist es Belastbarkeit? Ist es Verkürzung eines operativen Eingriffs? Ist es Genauigkeit einer Diagnose? Ist es die Erfolgsrate oder das Ausmaß einer wiedererlangten Mobilität nach einer chirurgischen Operation? Wenn Sie die Parameter gefunden haben, die für Ihr Produkt relevant sind, dann finden Sie auch Hinweise darauf, wie diese gemessen werden können – und welche Messlatte der State of the Art bereits liefert.Ermitteln Sie die Komplikationen
Welche müssen Sie, genauer gesagt der Patient und der Anwender, vernünftigerweise erwarten? Anhand welcher Aspekte können Sie die Sicherheit Ihres Produktes nachweisen? Ist es die Häufigkeit von Infektionen? Sind es Gewebeschäden beim Einsatz in Körperöffnungen? Ist es die Häufigkeit von Verletzungen beim Anwender durch den laienhaften Gebrauch elektrischer Wiederbelebung? Der State of the Art erzählt Ihnen, was passieren kann – mit welchen Häufigkeiten, Auftretenswahrscheinlichkeiten, und Schweregraden! Das kann man quantitativ messen.Gehen Sie strukturiert vor
Planen Sie die Erstellung des State of the Art separat; planen Sie eine Suchstrategie, die zum Ziel hat, eben diese Parameter, auf die es ankommt, überhaupt erst einmal zu ermitteln – Sie kennen womöglich gar nicht alle. Suchen Sie bevorzugt Review-Artikel, Guidelines, Normen und Standards, wobei Sie auf deren Qualität und Alter achten. Dies ist Ihr Ausgangspunkt, dort finden Sie die Hinweise zu den für Ihr Produkt konkret relevanten Parametern. Und dort finden Sie auch die mittlerweile etablierten, wenn nicht sogar geforderten Zahlen dazu. Dann schreiben Sie Ihren State of the Art genauso strukturiert nieder. Sie schreiben kein Review, Sie schreiben keinen ästhetisch erfreulichen Artikel, Sie schreiben nicht so, wie Sie es von der Einleitung Ihrer Diplom-, Master- oder Doktorarbeit her kennen. Schreiben Sie keine Perlenkette an Summaries. Sie schreiben einen zweckdienlichen State of the Art, also stellen Sie das relevante medizinische Gebiet und die benchmarks dar. Und die Alternativen. Maßgeschneidert für Ihr Produkt.Ihre konkreten Daten im Vergleich
In der klinischen Bewertung analysieren Sie die Daten zu Ihrem Produkt: Performance und Benefit anhand der geplanten Kriterien und Parameter, und auch Sicherheit und Nebenwirkungen anhand der geplanten Kriterien und Parameter. Der State of the Art gab Ihnen vor, welche Sie mindestens betrachten sollten. Jetzt haben Sie Ihre Zahlen dazu ermittelt. Vergleichen Sie sie nun mit den Zahlen aus dem State of the Art. So adressieren Sie die Frage, ob das Nutzen/Risiko-Profil Ihres Produktes zum einen gemäß Ihres eigenen Risikografens und zum anderen verglichen zum State of the Art akzeptabel ist. Die Abbildung dient der Visualisierung, wo sich die klinischen Daten wiederfinden und wie Sie damit umgehen. Aber betrachten Sie sie nicht als allgemeingültige mathematische Lösung. Entfernen Sie sich nicht vom klinischen Inhalt, denn die Parameter sind nicht gleich gewichtet und können sich nicht untereinander aufheben! Werden Sie absehbar eine eigene klinische Studie anstoßen müssen, um das Risikopotential Ihres Produktes zu ermitteln? Welche sind dann die Endpunkte, die Sie abdecken sollten? Das bezieht sich neben den Risiken auch auf den oben erwähnten klinischen Nutzen. Je früher Sie das erkennen, desto zielgerichteter und zeitiger können Sie Ihre Studie planen, falls sie nötig werden sollte. Zu guter Letzt: Anhand der gleichen Listen an Parametern besorgen Sie sich die Zahlen der in Frage kommenden Alternativen – wie stellt sich Ihr Produkt im Vergleich dar? Die MDR verlangt Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen Ihres Produkts. Die Daten von similar devices gaben den State of the Art vor, nämlich die relevanten Parameter, die Messgröße und den Bereich, in dem die zugehörigen Messwerte üblicherweise liegen (in rot). Die Daten von equivalent devices und natürlich Ihrem eigenen Produkt bestimmen Ihre Position darin (in blau). Alternative Produkte und Therapien - relevant sind solche mit vergleichbaren Benefit- und Risiko-Parametern - haben wiederum ihre eigene Position.
Die MDR verlangt Parameter zur auf dem neuesten medizinischen Kenntnisstand beruhenden Bestimmung der Vertretbarkeit des Nutzen-Risiko-Verhältnisses für die verschiedenen Indikationen Ihres Produkts. Die Daten von similar devices gaben den State of the Art vor, nämlich die relevanten Parameter, die Messgröße und den Bereich, in dem die zugehörigen Messwerte üblicherweise liegen (in rot). Die Daten von equivalent devices und natürlich Ihrem eigenen Produkt bestimmen Ihre Position darin (in blau). Alternative Produkte und Therapien - relevant sind solche mit vergleichbaren Benefit- und Risiko-Parametern - haben wiederum ihre eigene Position. Kein Ende, dafür Unterstützung in Sicht
Die Kenntnis über den State of the Art müssen Sie aktuell halten. Er kann sich ändern! Veraltet Ihr Produkt mittlerweile? Oder anders gefragt: Entfernt sich der State of the Art von Ihrem produkteigenen Nutzen/Risiko-Verhältnis? Gibt es Impulse für Neuentwicklungen? Gerne unterstützen wir Sie bei Ihrem State of the Art und Ihrer klinischen Bewertung mit unserem Know-how. Wie wäre es beispielsweise, die Erstellung und Aktualisierung des State of the Art für Ihre umfangreiche Produktgruppe als eigenen Prozess zu gestalten, um ihn in geeigneter Gruppierung nicht-redundant pflegen zu können? Kontaktieren Sie uns, dann sprechen wir darüber.Freundliche Grüße
Our blog posts are researched and created with the utmost care, but are only snapshots of the regulations, which are constantly changing. We do not guarantee that older content is still current or meaningful. If you are not sure whether the article you have read on this page still corresponds to the current state of regulation, please contact us: we will quickly place your topic in the current context.



