Das Nutzen-Risiko-Verhältnis und seine Bedeutung für die klinische Bewertung von Medizinprodukten
01.07.2024
Sie haben Fragen zum Beitrag oder möchten mehr über unsere Leistungen erfahren? Wir freuen uns auf Ihre Nachricht!Jetzt unverbindlich anfragen
Bei der klinischen Bewertung eines Medizinprodukts geht es verkürzt gesagt um dessen Nutzen-Risiko-Bewertung. Die Medical Device Regulation (EU) 2017/745 (MDR) legt den Zweck und die Anforderungen für die klinische Bewertung fest, wie z. B. den Nachweis der Konformität eines Produkts mit den einschlägigen allgemeinen Sicherheits- und Leistungsanforderungen, die Festlegung des erforderlichen Niveaus des klinischen Nachweises, wie der Plan für die klinische Bewertung (Clinical Evaluation Plan (CEP)) aussehen sollte usw. Aber im Kern geht es um die Bewertung des Nutzen-Risiko-Verhältnisses eines Produkts und um die Vertretbarkeit dieses Verhältnisses.Dies mag sich zunächst einfach anhören, aber jeder, der sich mit klinischen Bewertungen befasst, weiß wie schwierig das im Detail werden kann, wenn es um Fragen geht wie: Was ist der Nutzen für wen und unter welchen Bedingungen? Welche Risiken sollten berücksichtigt werden? Und schließlich: Wie sollte man beides gegeneinander abwägen? Und was (zum Teufel) bedeutet eigentlich "vertretbar"?Wir hoffen, mit den folgenden Ausführungen ein wenig Licht ins Dunkel zu bringen.
"[...] etwaige Risiken im Zusammenhang mit ihrer Anwendung gemessen am Nutzen für den Patienten vertretbar […] sein müssen". Und in GSPR 3c wird festgestellt, dass Hersteller "die Risiken einschätzen und bewerten [müssen], die mit der bestimmungsgemäßen Verwendung verbunden sind und die bei einer vernünftigerweise vorhersehbaren Fehlanwendung auftreten".Darüber hinaus wird in einem Positionspapier der European Association of Medical Devices Notified Bodies (Team-NB) (NB Position Paper on "Data generated from "Off-Label" Use of a product under the EU Medical Device Regulation 2017/745") die Erwartung der Benannten Stellen formuliert, dass Daten aus dem Off-Label-Use, also der zulassungsüberschreitenden Verwendung, wenn sie identifiziert werden, immer als Teil der klinischen Bewertung eines Produkts berücksichtigt werden sollten, um die Risiken einer zukünftigen missbräuchlichen Verwendung zu reduzieren oder auszuschließen.Anmerkung: Da die MDR die Begriffe "Off-Label-Use" ("zulassungsüberschreitende Verwendung") und "Misuse" ("fehlerhafte Verwendung", allgemein auch Fehlanwendung) in Anhang XIV Teil B einander zwar gegenüberstellt aber nirgends definiert, wird leider auch im Positionspapier nicht immer klar zwischen diesen beiden Begriffen unterschieden.Wir schließen daraus, dass sich die Nutzen-Risiko-Abwägung der klinischen Bewertung generell auf die Zweckbestimmung des zu bewertenden Produkts bezieht. Die klinische Bewertung sollte jedoch auch die Off-Label-Anwendung berücksichtigen. Zum einen, um die Risiken abzuschätzen, zum anderen aber auch, um — insbesondere bei einem systematischen Off-Label-Gebrauch — festzustellen, ob in der medizinischen Fachwelt tatsächlich ein Bedarf für eine solche neue Anwendung besteht.
d. h. die Risiken, die direkt mit dem Produkt selbst zusammenhängen (z. B. Bruch eines Implantats oder allergische Reaktion auf im Produkt enthaltene Materialien), aber auch der Risiken, die mit dem für die Anwendung des Medizinprodukts erforderlichen Verfahren verbunden sind (z. B. Blutungen oder Gewebeverletzungen im Falle eines chirurgischen Eingriffs). Wie der Nutzen können auch die Risiken des Verfahrens von Anwendern und Patienten beeinflusst werden.Dies bedeutet auch, dass die klinische Bewertung möglicherweise mehr Risiken berücksichtigt als die Risikomanagement-Akte, die sich auf die mit der Anwendung des Medizinprodukts verbundenen Risiken, d. h. die produktbezogenen Risiken, konzentriert.
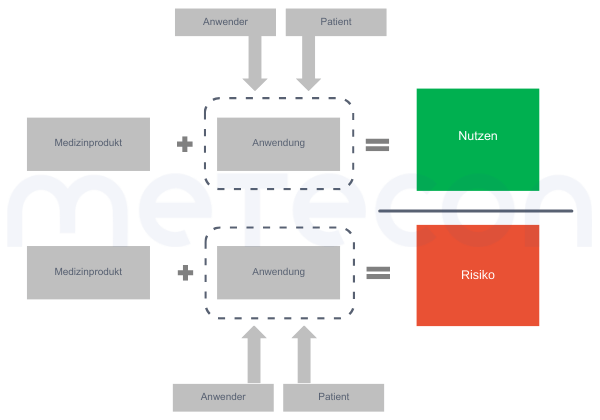
Abbildung 1: Faktoren, die bei der Einschätzung des Nutzen-Risiko Verhältnis eine Rolle spielenDie Hauptfrage, die sich klinische Evaluatoren in der Regel stellen, ist: Aber wie kann man nun Nutzen und Risiken vergleichen? Das erste Problem besteht darin, dass eine solche Bewertung wahrscheinlich sehr individuell ausfällt. So können beispielsweise einige Nutzen für eine bestimmte Bevölkerungsgruppe wichtiger sein (z. B. das ästhetische Ergebnis einer Zahnbehandlung für einen Schauspieler oder ein Model) als für eine andere. Das Gleiche gilt für Risiken, da verschiedene Menschen unterschiedliche Sicherheitsbedürfnisse haben. Daher müssen wir Vereinfachungen vornehmen und eine Abschätzung für einen "Durchschnittspatienten" treffen.Darüber hinaus fordert die MDR, dass wir den allgemein anerkannten Stand der Technik (State of the Art) berücksichtigen, wenn wir die Vertretbarkeit von Risiken in Abwägung mit dem Nutzen bestimmen (s. GSPR 1). Während die MDR auch für "Stand der Technik" keine Definition enthält, verweisen MDCG 2020-1 und MDCG 2020-6 auf die Definition der Good Regulatory Review Practices Group (IMDRF/GRRP) des International Medical Device Regulators Forum in ihrem Leitfaden "Essential Principles of Safety and Performance of Medical Devices and IVD Medical Devices" (WG/N47) und definiert "Stand der Technik" (SotA) wie folgt:"Developed stage of current technical capability and/or accepted clinical practice in regard to products, processes and patient management, based on the relevant consolidated findings of science, technology and experience.Note: The state-of-the-art embodies what is currently and generally accepted as good practice in technology and medicine. The state-of-the-art does not necessarily imply the most technologically advanced solution. The state-of- the-art described here is sometimes referred to as the "generally acknowledged state-of-the-art" (source: modified from IMDRF/GRRP WG/N47 Final:2018)".(eigene Übersetzung: Stand der aktuellen technischen Möglichkeiten und/oder der anerkannten klinischen Praxis in Bezug auf Produkte, Verfahren und Patientenmanagement, basierend auf den einschlägigen konsolidierten Erkenntnissen von Wissenschaft, Technik und Erfahrung. Hinweis: Der Stand der Technik umfasst das, was derzeit als gute Praxis in Technik und Medizin allgemein anerkannt ist. Der Stand der Technik bedeutet nicht unbedingt die technologisch fortschrittlichste Lösung. Der hier beschriebene Stand der Technik wird manchmal auch als "allgemein anerkannter Stand der Technik" bezeichnet. (Quelle: modifiziert von IMDRF/GRRP WG/N47 Final:2018))Die Berücksichtigung des Stands der Technik bedeutet also nicht, dass Sie Ihr Produkt mit der innovativsten Behandlung oder Technologie vergleichen müssen, sondern vielmehr mit dem, was der Patient bei einer Standardbehandlung erwarten könnte.Eine weitere Frage kann sein, wie man den Nutzen und die Risiken für diesen Durchschnittspatienten abwägt. Wie bereits erwähnt, gibt es meist mehr als einen Nutzen und sicherlich auch mehr als ein Risiko. Die Frage ist also, was man womit vergleichen soll. Ein direkter Vergleich eines Nutzens mit einem Risiko ist in der Regel nicht möglich, da Risiken und Nutzen in ihrem Ausmaß und ihrer Anzahl variieren (siehe Abbildung 2 A) und B)). Daher sollte die Gesamtsumme der Nutzen mit der Gesamtsumme der Risiken verglichen werden (siehe Abbildung 2 C)).
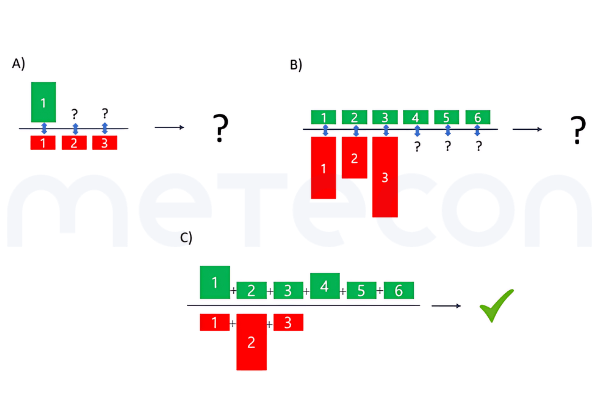
Abbildung 2: Vergleiche von Nutzen und Risiken. A) Direkter Vergleich eines Nutzens mit einem von mehreren Risiken, wobei alle Risiken das gleiche Ausmaß haben B) Direkter Vergleich verschiedener Nutzen mit gleichem Ausmaß mit verschiedenen Risiken mit unterschiedlichem Ausmaß und ungleicher Anzahl im Vergleich zu den Nutzen C) Vergleich eines Gesamtnutzens mit einem GesamtrisikoLeichter gesagt als getan? Hier ein Überblick darüber, wie man einen solchen Vergleich durchführen kann.
Scope der Bewertung: Bestimmungsgemäßer Gebrauch vs. Off-Label-Anwendung
Die bei der klinischen Bewertung zu berücksichtigende Anwendungsbedingungen sind in Artikel 2 (Begriffsbestimmungen) der MDR definiert, wo Nummer 44 die klinische Bewertung als ein Verfahren definiert zur "Bewertung der klinischen Daten zu einem Produkt, mit dem Sicherheit und Leistung, einschließlich des klinischen Nutzens, des Produkts bei vom Hersteller vorgesehener Verwendung überprüft wird". Nummer 24 definiert die Nutzen-Risiko-Abwägung als "die Analyse aller Bewertungen des Nutzens und der Risiken, die für die bestimmungsgemäße Verwendung eines Produkts entsprechend der vom Hersteller angegebenen Zweckbestimmung von möglicher Relevanz sind.“Anmerkung: Hervorhebungen bestimmter Formulierungen in diesen und den folgenden Zitaten aus regulatorischen Texten wurden von der Autorin hinzugefügt.In anderen Teilen der MDR wird jedoch eine umfassendere Analyse, insbesondere der Risiken, gefordert, wie in den Grundlegenden Sicherheits- und Leistungsanforderungen (General Safety and Performance Requirements (GSPRs)) in Anhang I, Kapitel I der MDR, die in GSPR 1 ausführen, dassWelcher Nutzen muss berücksichtigt werden?
Für wen besteht ein Nutzen?
Die MDR definiert in Kapitel 1 Artikel 2 Nummer 53 den klinischen Nutzen als "die positiven Auswirkungen eines Produkts auf die Gesundheit einer Person, die anhand aussagekräftiger, messbarer und patientenrelevanter klinischer Ergebnisse einschließlich der Diagnoseergebnisse angegeben werden, oder eine positive Auswirkung auf das Patientenmanagement oder die öffentliche Gesundheit". Während der klinische Nutzen also eindeutig das klinische Ergebnis für den Patienten betont, ist dies nicht der einzige Fokus der MDR. In GSPR 8 werden vorhersehbare Risiken und unerwünschte Nebenwirkungen ganz klar gegen den "für den Patienten und/oder Anwender […] ermittelten Nutzen" abgewogen.Die Definition des klinischen Nutzens für den Patienten ist gut nachvollziehbar und wird selbstverständlich in die klinische Bewertung einbezogen.Was den Nutzen für die Anwender betrifft, so kann dieser typischerweise einer der folgenden drei Kategorien zugeordnet werden:Wirtschaftliche Vorteile sind für sich genommen für die klinische Bewertung nicht relevant. Sie sollten daher nur dann berücksichtigt werden, wenn sie auch Auswirkungen auf den Patienten haben. So können beispielsweise niedrigere Gesamtbehandlungskosten die Therapie für bestimmte Patientengruppen leichter zugänglich machen. Oder kürzere Behandlungszeiten können für den Anwender einen wirtschaftlichen Vorteil darstellen, während gleichzeitig das Infektionsrisiko für den Patienten verringert wird, wenn es sich z.B. um eine Operation handelt.Erhöhter Komfort bedeutet in der Regel eine verbesserte Benutzerfreundlichkeit, was für den Patienten in der Regel den zusätzlichen Vorteil hat, dass die Gefahr von Bedienungsfehlern verringert wird.Geringere Auswirkungen auf die Gesundheit des Anwenders bedeuten normalerweise, dass ein geringeres Risiko besteht, dass der Anwender mit einer negativen Auswirkung auf die eigene Gesundheit rechnen muss. Eine solche Auswirkung wäre ein Schaden und würde daher unter die Sicherheitsdiskussion fallen, die ohnehin Auswirkungen auf den Anwender einschließt (siehe unten).Zusammenfassend lässt sich sagen, dass der für die klinische Bewertung relevante Anwendernutzen häufig auch einen Nutzen für den Patienten beinhaltet. In der Regel beziehen wir diese Patientenaspekte des Anwendernutzens in die klinische Bewertung ein, um den verschiedenen Anforderungen der MDR gerecht zu werden.Welcher Nutzen zählt?
Der Nutzen ergibt sich aus der Anwendung des Medizinprodukts, die ein bestimmtes Verfahren, z. B. eine Operation, umfassen kann. Das gesamte Verfahren und seine Ergebnisse bzw. der daraus resultierende Nutzen, können durch den Anwender und/oder den Patienten beeinflusst werden.Letztendlich gibt es eine Abwägung von Risiken und Nutzen in der Klinischen Bewertung. Und da wir bei dieser Bewertung alle Risiken berücksichtigen müssen (siehe unten), sollten wir auch alle Nutzen des oder der zu bewertenden Produkte berücksichtigen. Das mag einfach klingen. In der Praxis stellen wir jedoch manchmal fest, dass die Hersteller sich nur auf einen einzelnen Nutzen konzentrieren und andere in ihrer technischen Dokumentation nicht aufführen.Welche Risiken müssen berücksichtigt werden?
Für wen besteht ein Risiko?
Der Personenkreis, der bei der Risikobetrachtung zu berücksichtigen ist, wird durch die MDR glücklicherweise klarer definiert als dies beim Nutzen der Fall ist. GSPR 1: "Sie [...] gefährden weder den klinischen Zustand und die Sicherheit der Patienten noch die Sicherheit und die Gesundheit der Anwender oder gegebenenfalls Dritter, wobei etwaige Risiken im Zusammenhang mit ihrer Anwendung gemessen am Nutzen für den Patienten vertretbar und mit einem hohen Maß an Gesundheitsschutz und Sicherheit vereinbar sein müssen [...]".Kurz gesagt: Jedes Risiko für jede beteiligte Person muss berücksichtigt werden.Welche Risiken zählen?
Wie erwähnt, müssen alle Risiken berücksichtigt werden. Dazu gehören produktspezifische Risiken,Die Abwägung von Nutzen und Risiko
Nach der Erfassung aller Nutzen und Risiken muss in der klinischen Bewertung das sich daraus ergebende Nutzen-Risiko-Verhältnis erörtert werden:
Abbildung 1: Faktoren, die bei der Einschätzung des Nutzen-Risiko Verhältnis eine Rolle spielenDie Hauptfrage, die sich klinische Evaluatoren in der Regel stellen, ist: Aber wie kann man nun Nutzen und Risiken vergleichen? Das erste Problem besteht darin, dass eine solche Bewertung wahrscheinlich sehr individuell ausfällt. So können beispielsweise einige Nutzen für eine bestimmte Bevölkerungsgruppe wichtiger sein (

Abbildung 2: Vergleiche von Nutzen und Risiken. A) Direkter Vergleich eines Nutzens mit einem von mehreren Risiken, wobei alle Risiken das gleiche Ausmaß haben B) Direkter Vergleich verschiedener Nutzen mit gleichem Ausmaß mit verschiedenen Risiken mit unterschiedlichem Ausmaß und ungleicher Anzahl im Vergleich zu den Nutzen C) Vergleich eines Gesamtnutzens mit einem GesamtrisikoLeichter gesagt als getan? Hier ein Überblick darüber, wie man einen solchen Vergleich durchführen kann.
Etablierte Produkte
Gehört Ihr Medizinprodukt zu einer eher etablierten und weit verbreiteten Gruppe von Produkten, kann davon ausgegangen werden, dass das Nutzen-Risiko-Verhältnis dieser Produktgruppe bekannt ist und von der medizinischen Fachwelt und den Patienten allgemein akzeptiert wird, selbst wenn alternative Behandlungen in Betracht gezogen werden. Andernfalls würde es nicht routinemäßig eingesetzt werden. Wir gehen daher davon aus, dass es in diesem Fall ausreicht nachzuweisen, dass das zu bewertende Produkt einen ähnlichen oder höheren Nutzen und ähnliche oder geringere Risiken aufweist als die Produkte derselben Produktgruppe, die üblicherweise als Benchmarks herangezogen werden. Wenn dies nachgewiesen wurde, kann argumentiert werden, dass das Nutzen-Risiko-Verhältnis des zu bewertenden Produkts vertretbar ist. Selbstverständlich müssen auch die Behandlungsalternativen mit ihren Vor- und Nachteilen beschrieben werden, allerdings auf einem eher niedrigen Detailgrad.Es kann jedoch Ausnahmen von dieser Regel geben, insbesondere dann, wenn sich der Stand der Technik weiterentwickelt und der Markt/die klinische Anwendung eine Verzögerung bei der Anpassung an die neuen Produkttypen oder Behandlungen aufweist. Dies muss natürlich für das zu bewertende Produkt berücksichtigt werden.Innovative Produkte und Nischenprodukte
Für innovativere Produkte oder Nischenprodukte ist der oben genannte Ansatz nicht anwendbar, und es muss ein spezifischer Nutzen-Risiko-Vergleich für das zu bewertende Produkt vorgenommen werden. Doch wie kann dies geschehen?Schäden werden bereits in der Risikoanalyse nach ihrer Schwere und Häufigkeit gewichtet. Für die Nutzen-Risiko-Bewertung kann es hilfreich sein, eine ähnliche Gewichtung auf den Nutzen anzuwenden, um ihn mit den Risiken zu vergleichen. Wenn der Nutzen zum Beispiel lebensrettend ist, können lebensbedrohliche Risiken akzeptabel sein. Besteht der Nutzen dagegen nur in einem erhöhten Wohlbefinden, ist ein schweres Gesundheitsrisiko wahrscheinlich nicht akzeptabel. Obwohl dies extreme Beispiele sind, kann eine gewisse Abwägung von Nutzen und Risiken eine solide Grundlage für Ihre Nutzen-Risiko-Diskussion bilden. Wir raten jedoch dringend davon ab, das Nutzen-Risiko-Verhältnis vollständig mathematisch zu berechnen, da dies zum einen ziemlich komplex, mit den verfügbaren Daten unmöglich oder zu stark vereinfacht und daher irreführend sein kann und es zum anderen von der MDR oder den zugehörigen Leitlinien nicht verlangt wird.Fazit
Wie wir bereits diskutiert haben, ist die klinische Bewertung letztlich nichts anderes als eine Nutzen-Risiko-Bewertung. Obwohl einige Definitionen und Anforderungen in der MDR nicht ausdrücklich oder einheitlich beschrieben sind, können wir uns dieser Bewertung mit gesundem Menschenverstand nähern. Wir können uns fragen, was wir gerne wissen und berücksichtigen würden, wenn wir uns für oder gegen eine bestimmte Behandlung für uns selbst oder für einen Angehörigen als Patienten entscheiden müssten. Mit diesem Blickwinkel ist es sicher möglich stringente Szenarien über die Nutzen-Risiko-Bewertung zu schreiben, die auch eine Benannte Stelle überzeugen wird.Und wenn Sie jetzt noch spezielle Fragen zu Ihren Produkten haben oder Unterstützung brauchen, helfen wir gern, einen effizienten Ansatz für Ihre Nutzen-Risiko-Bewertung und klinische Bewertung zu finden.Übrigens: Wenn Sie mehr wissen möchten, ist unser Webinar im Herbst mit dem TÜV Süd zum Thema Best Practices für klinische Bewertungen mit spannenden Einblicken in praktische Beispiele vielleicht etwas für Sie. Einzelheiten erfahren Sie hier.
Unsere Blogbeiträge werden mit höchster Sorgfalt recherchiert und erstellt, sind jedoch lediglich Momentaufnahmen in der Regulatorik, und diese ist in stetem Wandel. Wir gewährleisten nicht, dass ältere Inhalte noch aktuell und aussagekräftig sind. Wenn Sie nicht sicher sind, ob der Beitrag, den Sie auf dieser Seite gelesen haben, noch dem aktuellen Stand der Regulierung entspricht, nehmen Sie bitte Kontakt zu uns auf: Wir ordnen Ihr Thema schnell in den aktuellen Kontext ein.



